КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ – класс окислительно-восстановительных периодических реакций. Механизм реакции напоминает работу устройства со сдерживающей защелкой.
Колебательные реакции протекают с участием катализатора (впервые это было обнаружено в процессе реакции при наличии ионов церия) и состоят, как правило, из двух стадий.Впервые такие реакции были обнаружены в 1951 московским химиком Б.П.Белоусовым.
а) скорость первой стадии должна заметно превышать скорость второй стадии;
б) на второй стадии должно возникать соединение, тормозящее протекание первой стадии (его называют ингибитором).
Подобную реакцию можно наблюдать при смешении водных растворов соли церия(III) (например, сульфат церия), бромата калия KBrO3 и броммалоновой кислоты HO(O)C – CH(Br) – C(O)OH. Реакционную массу подкисляют серной кислотой.
На первой стадии ион трехвалентного церия (возникший при диссоциации соли церия) восстанавливается бромат-анионом (его поставляет бромат калия). При этом ион Се(III) окисляется до Се(IV), что внешне заметно по изменению окраски реакционного раствора – ионы Се(III) в водном растворе бесцветны, а Се(IV) имеют желтую окраску.
10Ce3+ + 2BrO3– + 12H+ = 10Ce4+ + Br2 + 6H2O (I)
На следующей стадии образовавшийся ион Се(IV) реагирует с броммалоновой кислотой, окисляя ее:
4Ce4+ + HO(O)C – CH(Br) – C(O)OH + 2H2O =
= 4Ce3+ + HC(O)OH + 2CO2 + 5H+ + Br- (II)
При этом церий вновь становится ионом Се(III) и может вновь участвовать в реакции I. В данном случае он играет роль типичного катализатора, участвует в реакции, но при этом не расходуется, тем не менее, без него реакция не пойдет. Расходуются в процессе реакции бромат калия и броммалоновая кислота, церий лишь передает электроны от одного реагента к другому (исходные реагенты отмечены черным цветом, а продукты реакции – красным):
Своеобразие этой реакции состоит в том, что на стадии II в качестве побочного продукта возникает бром-анион Br–. Он ингибирует, то есть тормозит стадию I, а на стадию II влияния не оказывает. В результате в реакционной системе накапливаются продукты стадии II, прежде всего, ионы Се3+. В определенный момент, когда этих ионов накапливается очень много, ионы брома уже не могут далее тормозить стадию I, и она проходит с высокой скоростью. В системе вновь появляются ионы Се(IV), которые далее участвуют в медленной стадии II. Таким образом, ионы брома исполняют роль спускового крючка, не позволяющего до определенного момента стартовать первой стадии. Внешне это выглядит следующим образом (ионы Се(III) в водном растворе бесцветны, а Се(IV) имеют желтую окраску): реакционная масса мгновенно желтеет, а затем медленно обесцвечивается (рис. 4, стакан № 1). Цвет меняется приблизительно каждые полторы минуты, интервал времени сохраняется неизменным в течение нескольких часов. Если постепенно добавлять расходующиеся реагенты, то такие «химические часы» будут работать очень долго. При повышении температуры временнóй цикл колебательной реакции сокращается.
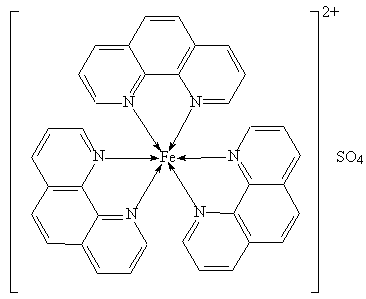
Существуют другие примеры колебательных реакций. В описанной выше системе ионы церия можно заменить ионами железа. Для этого используют комплекс сульфата Fe(II) с тремя молекулами фенантролина, который в водном растворе окрашен в красный цвет (этот комплекс широко используют для количественного определения железа):
Аналогичный комплекс Fe(III), появляющийся в результате окисления, окрашен в голубой цвет, в процессе реакции голубой цвет мгновенно становится красным, который вновь постепенно переходит в голубой (рис. 4, стакан № 2).
Если заменить броммалоновую кислоту лимонной [НОС(О)СН2]2С(ОН)С(О)ОН, то в присутствии каталитических количеств солей марганца возникает система, в которой цвет пульсирует каждые две минуты (рис. 4, стакан № 3). Щавелево-уксусная кислота НОС(О)СН2С(О)С(О)ОН с солями церия отсчитывает шестисекундные интервалы (стакан № 4). Интервалы времени на анимированном рисунке показаны условно, самый большой интервал смены цвета в стакане № 3, самый малый – в стакане № 4
Вскоре после открытия таких реакций удалось установить, что подобные процессы достаточно распространены. В результате была разработана общая теория колебательных процессов, к которым относят некоторые газофазные реакции (например, окисление углеводородов), гетерофазное окисление монооксида углерода, водорода, аммиака, этилена на металлических катализаторах, ряд полимеризационных процессов. Колебательные реакции определяют протекание некоторых важнейших биологических процессов: генерации нервных импульсов и механизма мышечного сокращения.
Михаил Левицкий

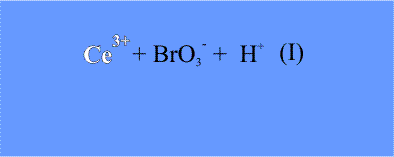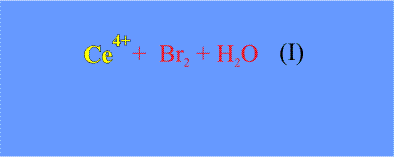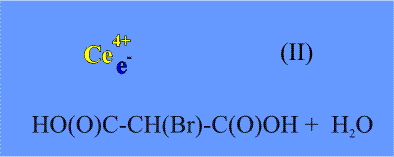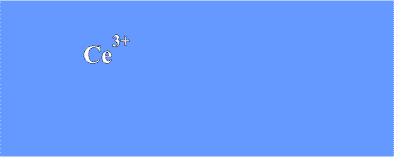

Комментариев нет:
Отправить комментарий