 Французский химик, доктор медицины Клод Луи Бертолле, стал первооткрывателем хлората калия, поэтому белые кристаллы до сих пор носят фамилию этого ученого - бертолетова соль. В конце XVIII века Клод Луи начал работать над созданием соли: он пропустил хлор (Cl₂) через горячий раствор гидроксида калия (KOH), тем самым получил вещество с формулой KClO₃ или хлорат калия.
Французский химик, доктор медицины Клод Луи Бертолле, стал первооткрывателем хлората калия, поэтому белые кристаллы до сих пор носят фамилию этого ученого - бертолетова соль. В конце XVIII века Клод Луи начал работать над созданием соли: он пропустил хлор (Cl₂) через горячий раствор гидроксида калия (KOH), тем самым получил вещество с формулой KClO₃ или хлорат калия.
Сейчас распространенным способом получения хлоратов является реакция диспропорционирования гипохлоритов, которая возникает при взаимодействии хлора с щелочами. Но нельзя описать единый процесс изготовления бертолетовой соли, ибо на современных предприятиях применяется разное оборудование, следовательно, каждый открывает для себя подходящий способ получения данного вещества. Но наиболее распространенный способ — реакция обмена между хлоратом кальция и хлоридом калия. Еще один популярный способ — получение бертолетовой соли при помощи электролиза хлорида калия. Можно сказать, что это подобный процесс тому, который описывал в своих трудах Бертолле.
Смесь Армстронга
Интересная и опасная взрывчатая смесь готовится на основе бертолетовой соли и красного фосфора. Химики для опытов смешивают эти два порошка только мягкой кистью на специальном стекле, потому что даже от простого трения может возникнуть взрывоопасная реакция. Если ударить по небольшому количеству смеси Армстронга молотком, результат будет просто ошеломительный: возникнет небольшой взрыв с громким хлопком и искрами. Данную смесь часто используют для изготовления пиротехники.

 Такой же опыт мне показывала моя учительница химии). Помню эту вспышку и молоток). А сейчас бертолетова соль в кабинетах химии школ запрещена(
Такой же опыт мне показывала моя учительница химии). Помню эту вспышку и молоток). А сейчас бертолетова соль в кабинетах химии школ запрещена(
Светящиеся циферблаты

Люминофоры подразделяют на временные и постоянно действующие. Вспомните елочные игрушки, покрытые люминесцентными красками. В состав таких красок входят короткоживущие люминофоры... Лампы выключены. Игрушки светятся ярко. Но через некоторое время их уже не видно. Если опять включить свет и затем выключить, игрушки снова загорятся.
Основу светящихся составов временного действия составляют сернистые соединения цинка, кальция, кадмия, стронция, бария. Их прокаливают с ничтожными количествами солей тяжелых металлов: меди, марганца, висмута. Одни люминофоры светятся голубым светом, другие — красным, третьи — зеленым.
Для часов неудобны люминофоры, светящиеся недолго (хотя раньше, а иногда, к сожалению, и сейчас некоторые предприятия такие вещества все-таки используют). Циферблаты должны быть различимы по крайней мере спустя 10—12 часов после освещения. Среди люминофоров временного действия такие составы есть Например, стронций-сульфидный люминофор; он излучает свет около 12 часов без подзарядки. Но у этого вещества есть существенный недостаток: в присутствии влаги происходит гидролиз сульфида стронция и выделяется сероводород — агрессивный газ, разъедающий механизм часов. Кандидат технических наук Е. Я. Бесидовский, Научно-исследовательский институт часовой промышленности
 Лови ошибку в химических уравнениях о фосфоре!
Лови ошибку в химических уравнениях о фосфоре!Древние фолианты сохранили для нас отдельные эпизоды из жизни отставного солдата и гамбургского купца. Звали его Хенниг Бранд (ок. 1630-?). Его купеческие дела шли не блестяще, и именно по этой причине он сремился выбраться из нищеты. Она его ужасно угнетала. И Бранд решил попытать счастья в алхимии. Тем более что в XVII в. в отличие от нашего XX в. считалось вполне возможным найти «философский камень», который способен превращать неблагородные металлы в золото.
Бранд провел уже множество опытов с различными веществами, но ничего дельного у него не получалось. Однажды он решил провести химический эксперимент с мочой. Выпарил ее почти досуха и оставшийся светло-желтый осадок смешал с углем и песком, нагревая в реторте без доступа воздуха. В результате Бранд получил новое вещество, которое обладало удивительным свойством-светиться в темноте.

Картина Джозефа Райта «Алхимик, открывающий фосфор» (1771 год), предположительно описывающая открытие фосфора Хеннигом Брандом.https://ru.wikipedia.org/wiki/Фосфор
Так в 1669 г. был открыт фосфор, играющий исключительно важную роль в живой природе: в растительном мире, в организме животных и человека.
Вскоре рецепт изготовления «холодного огня» стал известен И. Кункелю и К. Кирхмейеру, а в 1680 г. секрет получения фосфора был открыт в Англии знаменитым химиком Р. Бойлем. После смерти Р. Бойля его ученик немец А. Ганквиц, улучшив методику получения фосфора, наладил его производство и даже попытался изготовить первые спички. Он снабжал фосфором научные учреждения Европы и отдельных лиц, желающих приобрести его. Для расширения торговых связей А. Ганквиц посетил Голландию, Францию, Италию и Германию, заключая новые договора на продажу фосфора. В Лондоне им была основана фармацевтическая фирма, получившая широкую известность. Любопытно, что А. Ганквиц, несмотря на свою длительную работу с фосфором и весьма опасные опыты с ним, дожил до восьмидесятилетнего возраста.
http://www.alhimikov.net/phosfor/otkrytie.html
Цвет неорганических веществ.
У неорганических веществ цвет обусловлен электронными переходами и переносом заряда от атома одного элемента к атому другого. Решающую роль здесь играет внешняя электронная оболочка элемента.
Как и в органических веществах, возникновение цвета здесь связано с поглощением и отражением света.
Вообще, окраска вещества складывается из суммы отражённых волн (или прошедших через вещество без задержки). При этом цвет вещества означает, что из всего диапазона длин волн видимого света им поглощаются определённые кванты. В молекулах окрашенных веществ энергетические уровни электронов расположены близко друг к другу. Например, вещества: водород, фтор, азот – кажутся нам бесцветными. Это происходит из-за того, что кванты видимого света не поглощаются ими, так как не могут перенести электроны на более высокий уровень. То есть, через эти вещества проходят ультрафиолетовые лучи, не воспринимаемые человеческим глазом, поэтому и сами вещества для нас не имеют цвета. У цветных веществ, например, хлора, брома, йода, электронные уровни расположены теснее друг к другу, поэтому кванты света в них способны перевести электроны из одного состояния в другое [2].
Опыт. Влияние иона металла на окраску соединений.
Приборы и реактивы: четыре пробирки, вода, соли железа(II), кобальта(II), никеля (II), меди (II).
Выполнение опыта. В пробирки наливаем 20-30 мл воды, вносим по 0,2 г солей железа, кобальта, никеля и меди и перемешиваем до растворения. Окраска раствора железа стала жёлтой, кобальта – розовой, никеля - зелёной, а меди – синей.
Вывод: Как известно из химии, структура этих соединений одинакова, однако они имеют различное число d-электронов: у железа – 6, у кобальта – 7, у никеля – 8, у меди – 9. Это число влияет на окраску соединений. Поэтому и видно различие в цвете.Химия цвета. Вещества - хамелеоны
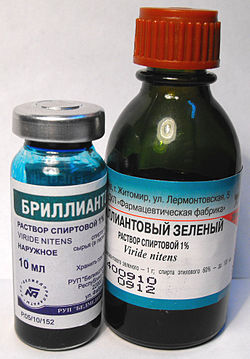 Бриллиантовый зелёный впервые был получен в 1879 году в Германии. Об антисептических свойствах этого вещества узнали только в следующем столетии. В середине XX века бриллиантовая зелень, долговечная и дешёвая в производстве, получила широкое распространение в Советском Союзе.
Бриллиантовый зелёный впервые был получен в 1879 году в Германии. Об антисептических свойствах этого вещества узнали только в следующем столетии. В середине XX века бриллиантовая зелень, долговечная и дешёвая в производстве, получила широкое распространение в Советском Союзе.
В русский язык название этого красителя попало из французского языка. В сухом виде бриллиантовый зелёныйпредставляет собой золотисто-зелёные комочки, по латыни viridis nitens, — дословно «зелёный блестящий». При переводе на французский было использовано слово brillant — по-французски «блестящий», что русский переводчик механически перевёл как «бриллиантовый»[3].
Кроме России и нескольких стран на постсоветском пространстве, бриллиантовый зелёный в медицине нигде больше не используют, хотя, например, в Европе, он входит в список разрешённых медицинских препаратов. Возможных причин может быть три[3]. Во-первых, в странах Запада принята доктрина доказательной медицины, а молекулярный механизм действия этого (и других) красителей неизвестен до сих пор. Во-вторых, до сих пор точно не известно, обладает ли бриллиантовый зелёный канцерогенными свойствами. В-третьих, при использовании для лекарственного средства важна и эстетическая сторона, отчего в западной медицине принимаются во внимание и изменения во внешнем виде пациента при применении препарата].
На постсоветском пространстве раствор бриллиантового зелёного широко известен под разговорным названием зелёнка.Википедия
Запишите уравнения реакций железа с хлором, серой, кислородом.
Хемилюминесценция
Хемилюминесценция – излучение тел в видимом диапазоне при протекании химической реакции. Основывается данный эффект на том, что в результате некоторых химических взаимодействий может выделяться энергия, причем выделяется она в виде света. Связано это с переходами электронов между энергетическими уровнями. По закону сохранения, электрон, переходя с более высокого энергетического уровня на более низкий должен отдать часть своей энергии, равную разности энергий этих уровней. Отдача может происходить как в виде выделения тепла, так и в форме испускания кванта света. Рассмотрим весь процесс в целом более подробно.
Процесс хемилюминесценции разделяют на 2 этапа:
1) Образование продукта в электронном возбужденном состоянии (хемилюминесцентная реакция); Это означает, что в получившемся веществе электроны молекул или атомов занимают не все нижние уровни, и существуют пустые незаполненные места.
A + B -> C*
2) Испускание кванта света (люминесценция); Электронам энергетически выгоднее перейти на более низкие уровни, если там есть незаполненные места.
C* -> C + фотон
Важно отметить, что биолюминесценция является частным случаем хемилюминесценции. Основное отличие состоит в том, что реакции проходят в живых организмах.
 Рис 1. Биолюминисценция в пещере Рис 1. Биолюминисценция в пещере
Как правило, с помощью хемилюминесценции определяют составы веществ, наличие различных радикалов, металлов, окислов, проводят анализ нанотрубок, квантовых точек, биологических объектов и т.п. Поскольку свечение происходит в видимом спектре, то это автоматически открывает возможность использовать видео- и фото камеры стандартного диапазона длин волн. Однако зачастую излучение имеет очень слабовыраженный характер, и, следовательно, регистрирующая техника должна обладать высокой чувствительностью.
|
 Какое вещество яляется катализатором реакции горения сахара? Запишите уравнение реакции горения сахарозы (C12H22O11)
Какое вещество яляется катализатором реакции горения сахара? Запишите уравнение реакции горения сахарозы (C12H22O11)
Как вырастить кристалл?
Что такое алхимия?
Алхимическими экспериментами занимался даже Ньютон. Смотрите, очень интересно...
Coca Cola - неплохое моющее средство!
Какая кислота входит в состав этого напитка?
Это не магия, это галлий.
Найдите информацию об этом металле. Какое отношение к нему имел Д.И. Менделлев?
где применяют этот металл?
Вау! Взрывы щелочных металлов в воде: рубидия и цезия!
Напишите уравнение реакции ртути с азотной кислотой
Как соли окрашивают пламя?
Один из любимейших моих выпусков Ералаша!
ОтветитьУдалить