 7 класс! Если вы решили 3 задачи этого упражнения,
7 класс! Если вы решили 3 задачи этого упражнения,к самостоятельной работе вы готовы! Если решили 5, поздравляю, ВЫ - СУПЕРМОЗГ! Удачи!
Структура льда: образование водородных связей между молекулами воды:
1
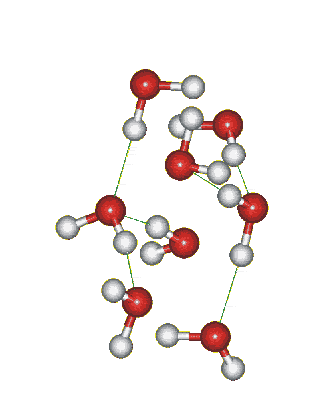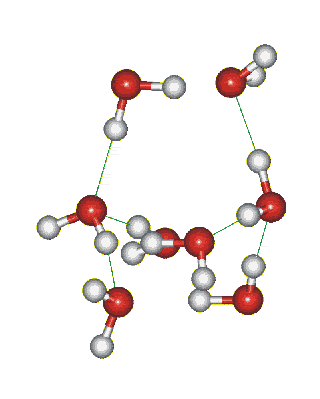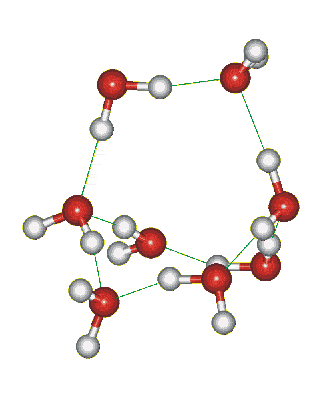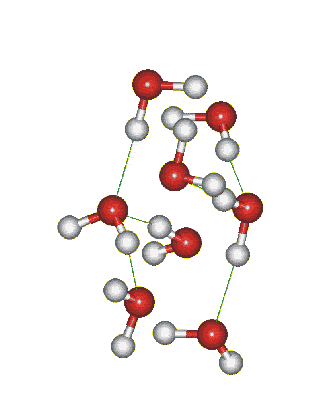
 Сможешь ли понять это видео? Try to translate!
Сможешь ли понять это видео? Try to translate!Реакция разложения и соединения - два в одном! Напишите эти уравнения!

http://iighjgh.blogspot.com/2011/11/blog-post_3878.html



Кислороду посвящается...
Запишите уравнение реакции горения водорода:)
Водород - топливо будущего!
Расставьте коэффициенты в уравнениях химических реакций:
Вариант 1 Фамилия__________________
а)
Fe(ОН)3 → Fe2О3 + Н2О;
б) Аl 2О3
+ H2SО4 → Al2(SО4)3 + Н2О;
в) НСl + Сг2О3 → СгСl3 + Н2О;
г) Na + Н2О
→ NaOH + Н2;
Оценка _______
Вариант
2
Фамилия__________________
а) АlСl3 + NaOH → Аl(ОН)3 + NaCl;
б) Fe2О3 + HNО3 → Fe (NО3)3 + H2О;
в)
Аl + І 2 → АlІ3;
г) Fe2О3 + Н2 → Fe + Н2О;
Оценка _______
|
Вариант 3 Фамилия__________________
а) FeСl3 + КOH → Fe(ОН)3 + КCl;
б) Аl2О3 + HNО3 → Аl(NО3)3 + H2О;
в) Аl + F 2 → АlF3;
г) Сг2О3 + Н2 → Сг + Н2О;
Оценка _______
|
Вариант 4 Фамилия__________________
а) Аl(ОН)3 → Аl2О3 + Н2О;
б) Fe 2О3 + H2SО4 → Fe 2(SО4)3 + Н2О;
в) НІ + Сг2О3 → СгІ3 + Н2О;
г) К + Н2О → КOH + Н2;
Оценка _______
|
Правила составления химических уравнений
1. В левой части уравнения записать формулы веществ, вступающих в реакцию (реагентов) . Затем поставить стрелку.
а) N2 + H2 →
б) Al(OH)3 →
в) Mg + HCl →
г) СaO + HNO3→
2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов) . Все формулы составляются в соответствии со степенью окисления. (валентностью)
а) N2 + H2 → NH3
б) Al(OH)3 → Al2O3 + H2O
в) Mg + HCl → MgCl2 + H2
г) СaO + HNO3→ Ca(NO3)2 + H2O
3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно быть одинаковое число атомов. Это достигается расстановкой коэффициентов перед формулами веществ.
Алгоритм расстановки коэффициентов
в уравнении химической реакции.
1. Подсчитать количество атомов каждого элемента в правой и левой части.
2. Определить, у какого элемента количество атомов меняется, найти Н. О. К.
3. Разделить Н. О. К. на индексы – получить коэффициенты. Поставить коэффициенты перед формулами.
4. Пересчитать количество атомов, при необходимости действия повторить.
5. Начинать лучше с атомов О или любого другого неметалла (если только О не находится в составе нескольких веществ) .
а) N2 + 3H2 → 2NH3
б) 2Al(OH)3 → Al2O3 + 3H2O
в) Mg + 2HCl → MgCl2 + H2
г) СaO + 2HNO3→ Ca(NO3)2 + H2O
Подумай и реши!
Подбери пропущенные коэффициенты в следующих уравнениях химических реакций:
? Mg + O2 = 2MgO
? Fe + 3Cl2 = ? FeCl3
? Al + ? S = Al2S3
? Cа+ ?O2 = ? CаO
Fe2O3+?Al=Al2O3+?FeА. В. Мануйлов, В. И. Родионов Основыхимии. Интернет-учебник.
Массовая доля химического элемента в сложном веществе
Ты, должно быть, понимаешь, что такое доля (она же часть). Выразить долю можно по-разному: в виде обыкновенной или десятичной дробей, или в виде процентов. Как рассчитывают массовую долю элемента на уроках химии?
Валентность. Молекулярные формулы.
Введем еще один важный термин, нужный нам для дальнейшей работы: валентность. Валентность атома – это его способность образовывать определенное число химических связей с другими атомами. Например, число черточек, отходящих от символа элемента в структурных формулах, равно валентности этого элемента. Посмотрите на приведенные ниже структурные формулы некоторых веществ – из них видно, что водород и хлор одновалентны, кислород двухвалентен, углерод четырехвалентен, а азот трехвалентен.
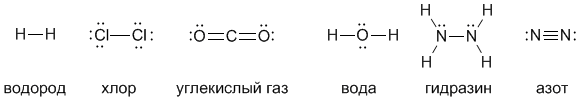
Точками здесь обозначены неподеленные пары электронов, но в структурных формулах их показывают не всегда (в связывании они непосредственно не участвуют, хотя важны с точки зрения правила октета). В структурных формулах каждая черточка – это именноподеленная пара электронов. Поэтому можно дать такое определение валентности:
Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами.
Поскольку в химической связи участвуют только электроны внешних оболочек, такие электроны называют валентными. Единичная (простая) связь возникает, когда атомы делят между собой одну пару валентных электронов.
Структурные формулы наглядно показывают состав вещества, последовательность связывания атомов друг с другом и валентность элементов. Но если такая подробная информация не нужна, состав вещества можно записывать в виде сокращенных химических формул:
H2 (водород) Cl2 (хлор) CO2 (углекислый газ) H2O (вода) N2H4 (гидразин) N2 (азот)
В данном случае все вещества состоят из молекул, поэтому такие формулы называют не просто сокращенными, а молекулярными. Цифра, стоящая внизу справа от символа элемента, называется индексом. Индекс показывает, сколько атомов данного элемента содержится в молекуле. Индекс 1 никогда не пишут. http://www.hemi.nsu.ru/ucheb133.htm
Вещество.
Вы уже изучали физику и
привыкли к понятию "физическое тело". Физическое тело - это любой
предмет, имеющий объем, массу, плотность, температуру, твердость,
вязкость, электропроводность и многие другие подобные свойства,
называемые физическими.
Допустим, этот предмет - кусочек свинца. В физическом
эксперименте можно, например, бросать свинцовый предмет с разной
высоты, чтобы определить ускорение свободного падения. В другом опыте
можно измерить объем этого кусочка и определить плотность свинца. Можно
нагреть свинец, чтобы расплавить его и определить температуру плавления.
Можно измерить электропроводность свинца. А можно погрузить в воду и измерить выталкивающую силу. Во всех этих опытах будут проявляться разные физические свойства предмета. Но если в первом опыте с бросанием предмета не так уж и важно, из чего он сделан - из свинца, резины или железа, то во всех остальных опытах исследователь получит совершенно разные результаты для свинцового, резинового и железного физического тела.
Можно измерить электропроводность свинца. А можно погрузить в воду и измерить выталкивающую силу. Во всех этих опытах будут проявляться разные физические свойства предмета. Но если в первом опыте с бросанием предмета не так уж и важно, из чего он сделан - из свинца, резины или железа, то во всех остальных опытах исследователь получит совершенно разные результаты для свинцового, резинового и железного физического тела.
Значит, во многих случаях важно, из какого вещества сделан тот или иной предмет.
То, из чего состоят физические тела, то есть окружающие нас предметы, называется веществом.
 Если
взять не свинец, а мягкий серебристый металл натрий, то с таким
физическим телом лучше не проводить опытов по измерению выталкивающей
силы в воде. На глазах у исследователя, который решится проделать такой
эксперимент, погруженный в воду кусочек натрия всплывет и начнет бурно
пузыриться, бегая по поверхности воды расплавленной каплей. Затем вокруг
того, что осталось от натрия, появятся красные всполохи огня и,
наконец, если кусочек натрия был достаточно велик, раздастся
оглушительный взрыв. Даже если взрыва не последует, после окончания
опыта наш исследователь обнаружит, что натрий исчез! Он превратился в
какое-то другое вещество!
Если
взять не свинец, а мягкий серебристый металл натрий, то с таким
физическим телом лучше не проводить опытов по измерению выталкивающей
силы в воде. На глазах у исследователя, который решится проделать такой
эксперимент, погруженный в воду кусочек натрия всплывет и начнет бурно
пузыриться, бегая по поверхности воды расплавленной каплей. Затем вокруг
того, что осталось от натрия, появятся красные всполохи огня и,
наконец, если кусочек натрия был достаточно велик, раздастся
оглушительный взрыв. Даже если взрыва не последует, после окончания
опыта наш исследователь обнаружит, что натрий исчез! Он превратился в
какое-то другое вещество!
Но если измерять температуру плавления или
электропроводность предмета, сделанного из того же натрия, то эти опыты,
скорее всего, окончатся благополучно, хотя результаты будут отличаться
от опытов с физическими телами из какого-нибудь другого вещества.

. Разделите явления на физические и химические:
1. вода превращается в пар,
2. вода превращается в лед,
3. желудок переваривает пищу,
4. брусок дерева нагревается трением,
5. брусок дерева дымится от трения,
6. кусок стекла раскалывается в костре,
7. дрова сгорают в костре.
А. В. Мануйлов, В. И. Родионов Основы
химии. Интернет-учебник.
Комментариев нет:
Отправить комментарий